那个难题和阴极阻抗相关。
看右图:

图中的黄瓜电池组,电流有12.12V?无语脸,究竟是12.12V却是12时12分?
为甚么黄瓜能水力?这是碱合金的阴极阻抗在起促进作用。但是,黄瓜电池组的稳步组织工作潜能估算有限,不晓得若想给智能手机紧急电池?
关上《有机化学》,他们在水解还原成的段落江苏舜天队看见合金的公益活动优点次序,如下表所示:
K、 Ca、 Na、 Mg 、Al 、Zn、 Fe 、Sn 、Pb、 (H) 、Cu、 Hg 、Ag 、Pt、 Au。
在碱性水溶液的前提下,原素会水解,比如铜,它会被水解正式成为Cu2OCu_{2} O。铜水解后,与尾端的铜逐步形成了共振频率,此种共振频率叫作阴极阻抗。其方程组如下表所示:
Cu2++2e=CuCu^{2+} +2e=Cu
特别注意,方程组右边是铜的水解态,右边是它的还原成态。从右边的原素变成右边的状态叫作水解,反过来叫作还原成。
他们看见,铜原子丢失了两个电子后,就逐步形成了它的水解态。这样一来,铜的水解态与尾端铜之间就会逐步形成一个电流,叫作阴极阻抗。
在碱性水溶液中,原素的阴极阻抗表如下表所示:

这张表中,右边是某原素的水解状态变化,中间是反应式,右边是共振频率。
特别注意到一个重要的参照,就是氢,在上表的最底部,它的阴极阻抗为零。其它所有原素的阴极阻抗值都是参照H的阴极阻抗来给定的。
特别注意到二价铜的阴极阻抗是0.3419V,二价锌的阴极阻抗是-0.7618V,他们把两者放在一起,会怎样呢?
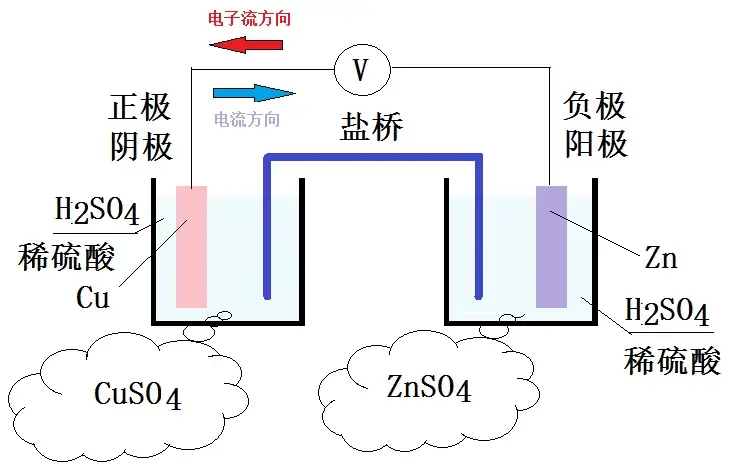
特别注意,图中右边是铜阴极,右边是锌阴极。
由于铜的阴极阻抗比锌要高,所以电子流不断地从锌阴极流入铜阴极,铜离子得到电子后被还原成,而更多的锌被水解,也即锌原子的水解数不断地稳步升高。其结果就是锌被腐蚀掉了,直到锌阴极完全被腐蚀光,反应才停止。
由于铜的阴极阻抗是0.3419V,锌的阴极阻抗是-0.7618V,于是电池组的电动势E为:
E=φ(Cu2+/Cu)−φ(Zn2+/Zn)=0.3419−(−0.7618)=1.1037VE=\varphi (Cu^{2+} /Cu )-\varphi (Zn^{2+} /Zn )=0.3419-(-0.7618)=1.1037V
这就是锌和铜的电池组反应。
其中,左右两边都叫作半反应。它们的反应式为:
右边:Cu2++2e=CuCu^{2+} +2e=Cu
右边:Zn−2e=Zn2+Zn-2e=Zn^{2+}
此种电池组叫作原电池组。
难题:原电池组的电流与甚么相关?答案是:液体中的离子浓度。
他们来看右图:
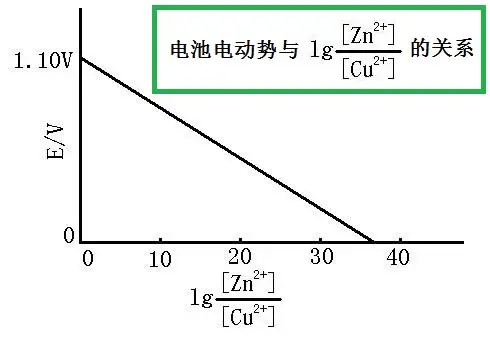
原来电池组电动势与离子浓度Cu2+Cu^{2+} 和Zn2+Zn ^{2+}相关。对此种现象进行的定量分析方法叫作能斯特方程组。
他们先百度一下,看看能斯特其人:

现在,他们回头再来看铜-锌原电池组。在这里,其实有两个互相对立的过程,第一个是原电池组过程,也即铜和锌分别分解为Cu2+Cu^{2+} 和Zn2+Zn ^{2+},并由此产生电能;第二个是电解过程,当电流流过水溶液时,电解过程把铜和锌的化合物(指水解铜和水解锌)被分解还原正式成为铜和锌单质合金。
他们把利用铜-锌产生电流的装置称为原电池组,他们已经晓得它产生的电流大约为1.1V左右;他们把利用铜和锌的化合物通过电解产生铜和锌单质的装置称为电解池,电解池的电流会高于1.1V,大约为1.0V到4.0V之间。
不管是原电池组却是电解池,将电子流注入到电解质水溶液的阴极中,会发生还原成反应,此阴极被称为阴极。阴极附近电解质水溶液中会出现负电荷,阴极附近的单质合金被还原正式成为离子;发生相反促进作用的阴极被称为阳极,正电荷由阳极进入水溶液,消耗阴极附近的负电荷也即电子,而反应物则发生了水解反应,离子转化为单质合金。
他们来看右图:
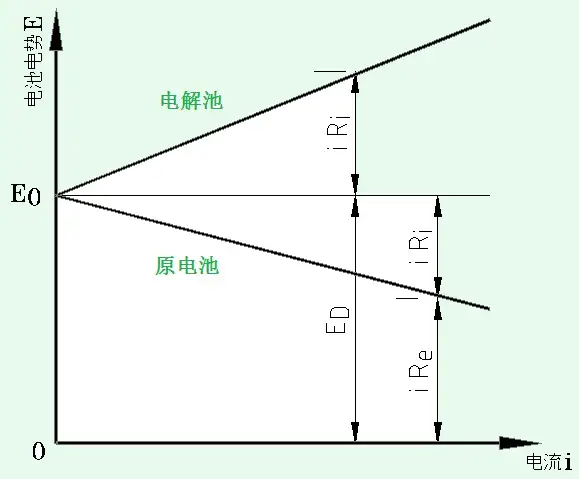
上图中他们能看见电池组电动势随着电流变化的情况
在原电池组装置中,电流和共振频率可以同时检验。他们发现,原电池组的共振频率E会随着流过电解池的电流升高而下降。并且共振频率E由电池组内阻RI和外电阻Re上的分压组成,也即:
E0=iRi+iReE_{0} =iR_{i } +i R_{e }
E=E0−iRiE=E_{0} -i R_{i}
原电池组输出功率P为电流与电势的乘积,也即:
P=iE=i(E0−iRi)P=i E=i (E_{0} -i R_{i } )
当i=E02Rii =\frac{E_{0} }{2R_{i } }和E=E0/2E=E_{0} /2时,原电池组输出功率最大。
有趣的是:在可重复电池的电池组中,原电池组和电解池居然被统一了:正常用电过程属于原电池组过程,而电池过程则属于电解池过程。

关于原电池组的详细描述,建议大家去看一本书,书名是:《电化学》

=================
特别注意到一个很有意义的难题:
他们都晓得,铜导线在自然情况下表面会发黑,这是它的水解,铜的表面会生成Cu2+/CuCu^{2+} /Cu 对。如果有水汽沾染,则会进一步与二水解碳反应生成铜绿,即Cu₂(OH)₂CO₃,一种固态物质。
他们晓得,化学反应进行究竟的前提是生成气体或者难溶的固体物质。当铜生成铜绿后,铜就会不断地受到稳步性的腐蚀。
如果他们在铜的表面镀上一层锡,而锡的阴极阻抗和铜的阴极阻抗有如下表所示关系:φ(Sn2+/Sn)=−0.1375V<φ(Cu2+/Cu)=0.3419V\varphi (Sn ^{2+} /Sn )=-0.1375V<\varphi (Cu^{2+} /Cu )=0.3419V
查看碱合金的活泼性,他们发现锡排在铜的右边,所以锡比铜活泼。结果,锡就会不断地被腐蚀掉,而铜则不断地得到还原成。
在这里,锡正式成为牺牲原素。
在实际的电路中,铜的表面镀锡十分常见。不管是导线,继电器触头导电杆,却是集成电路的表面,还有母线表面,常常见到铜镀锡。如果他们不希望锡正式成为牺牲原素,那么该怎么办?
请记住此种现象的名称:合金材料的电化学腐蚀。
为了避免让锡正式成为牺牲原素,就必须在铜上完整地镀上锡,并且不能有破口。否则,就一定会让锡正式成为牺牲原素。
反过来,如果他们在铜的表面镀上一层银,或者镀上一层铬,如果镀层没有镀满,或者有破口,则因为铜比两者都活泼(见合金公益活动次序表)。则铜将会受到稳步性腐蚀。











